

一文了解GSK836乙肝新药最新动态。
慢性乙型肝炎(CHB)是一种由乙型肝炎病毒(HBV)引起的全球性健康问题,其治疗一直是医学界的研究重点。乙肝治疗目前可归纳为三大治疗方案,直接抑制病毒繁殖(抗病毒治疗)、功能性治愈及完全治愈。抗病毒治疗是基础的治疗方法,目前已上市的药品均为抑制病毒的药物,主要分为核苷(酸)类和干扰素类药物。
核苷(酸)类似物:核苷(酸)类似物通过抑制病毒DNA多聚酶和逆转录酶的活性,同时竞争性抑制核苷酸进入病毒DNA链,终止病毒DNA链的延长,干扰病毒DNA的合成,从而发挥抗病毒作用。
目前已获得批准上市的口服药物多属于该类药物,国内外仍有不少企业在从事该类药物研发。其代表药物有拉米夫定、阿德福韦酯、恩替卡韦、替比夫定、Levovir(Clevudine)、Besivo(besifovir)、富马酸替诺福韦二吡呋酯(TDF)、替诺福韦艾拉酚胺(TAF)等。
干扰素类药物:干扰素包括普通干扰素和长效干扰素,其作用机制为促进机体的抗病毒免疫。其代表药物有派罗欣、赛若金、凯因益生、长效干扰素派格宾等。
当前乙肝治疗药物,主要是通过作用病毒生命周期其中某一步骤或通过一定的免疫调节起作用,实际临床效果有限,且存在诸多副作用,如耐药性、肝功能异常等。针对当前治疗策略的局限性,新药研发成为慢性乙肝治疗领域的重要研究方向。开发新型作用方式药物以实现当前学界普遍认可的功能性治愈甚至彻底治愈成为当务之急。
乙肝新型治疗药物将靶点瞄向乙肝病毒复制全生命周期,包括靶向乙肝病毒进入肝细胞、HBx蛋白、cccDNA形成、pgRNA、HBsAg形成和分泌等,以及一些直接靶向宿主因素新型疗法。
乙肝新药——Bepirovirsen(GSK836)
全球生物制药公司已经开发出许多新机制乙肝候选药物,据药融云数据库统计,目前已有超过50种乙肝新药处于不同开发阶段,超过25种药物已超过I期试验,相关结果引人关注。比如Ionis Pharmaceuticals和GSK合作开发的Bepirovirsen(GSK836,GSK3228836),是用于慢性乙型肝炎治疗的一款反义寡核苷酸(ASO),靶向所有HBVRNA,包括HBV信使RNA和前基因组RNA。
GSK836乙肝新药最新动态查询(研发状态)

图片来源:药融云全球药物研发数据库
bepirovirsen能够精准匹配乙肝病毒的RNA,唤出肝细胞里的酶,摧毁来自乙肝的RNA,让它失去活性。失去了RNA,乙肝病毒就无法复制,也不能产生乙肝病毒抗原。此外,这种药物还能进一步刺激人体免疫系统,协助其消灭血液中的乙肝病毒。
总的来说,bepirovirsen具有两面的作用,一个是抑制乙肝病毒的复制,另一个是促进免疫系统对乙肝病毒的攻击,减少乙肝慢性感染。该疗法最初由IonisPharmaceuticals发现,并在2019年通过协议,转为由GSK与Ionis共同开发。目前正处于治疗慢性乙型肝炎病毒(HBV)感染的Phase3期临床研究阶段。
GSK836乙肝新药临床试验最新动态
GSK-836(Bepirovirsen)凭借良好的动物、1、2期临床试验成绩,被誉为新一代“乙肝明星药物”。此前公布bepirovirsen的Phase2b期临床试验(B-Clear)显示:
(1)在研究开始前便稳定接受核(苷)酸类似物治疗的慢乙肝患者(HBsAg>100IU/mL,HBVDNA<90IU/mL,丙氨酸氨基转移酶(ALT)<2倍正常上限)中,经过与24周的Bepirovirsen联合用药后,观察到第一种用药方案【Bepirovirsen(GSK836)300mgw/LD(使用负荷剂量)用药24周】有28%的慢乙肝患者实现HBsAg<LLOQ和HBVDNA<LLOQ,而停药24周后有9%的慢乙肝患者达到主要终点。
(2)Bepirovirsen单药治疗未经治慢乙肝患者(HBsAg>100IU/mL,HBVDNA>2000IU/mL,丙氨酸氨基转移酶(ALT)<3倍正常上限),经过24周用药后,观察到第一种用药方案【Bepirovirsen(GSK836)300mgw/LD(使用负荷剂量)用药24周】有29%的慢乙肝患者实现HBsAg<LLOQ和HBVDNA<LLOQ,而停药24周后有10%的慢乙肝患者达到主要终点。
根据2b期取得的有希望的临床结果,bepirovirsen为慢性乙肝的功能性治愈提供可能。
2023年12月,在墨西哥城市洛斯卡沃斯(LosCabos)举办的Hep-DART2023大会上,研究人员发表了一项表征Bepirovirsen治疗过程中ALT升高幅度和升高时间点以及跟Bepirovirsen治疗应答之间关系的研究分析。
研究结果显示,大多数参与者(61/70[87%])的ALT在第12周时出现最大升高。与基线相比,ALT的最大升幅从1.0倍到48.5倍不等(下图)。最大HBsAg下降≥3log10IU/mL的参与者的最大ALT升高中值最大(与基线相比升高5.0-5.1倍);只有2名最大HBsAg下降≥3log10IU/mL的参与者的ALT与基线相比没有升高。

HBVDNA下降幅度最大的是最大HBsAg下降幅度≥3log10IU/mL的参与者。仅在最大HBsAg下降≥3log10IU/mL的参与者中观察到治疗期间HBsAg下降和HBVDNA<LLOQ的情况(22人)。在HBsAg下降≥3log10IU/mL且最大ALT>10倍基线的参与者中,大多数实现了HBsAg阴转(10/11);然而,HBsAg阴转可以在ALT没有/极少上升的情况下实现。
研究认为,在ALT升高的B-ClearNot-on-NA队列中,大多数参与者的ALT在第12周达到峰值。ALT升高幅度更大的受试者HBsAg和HBVDNA的下降幅度更大,这表明这些短暂的ALT升高可能是免疫介导的HBV感染肝细胞清除的一种表现形式。
在早前11月初2023美国肝病学会年会上(AASLD2023),研究人员曾报道Bepirovirsen可诱导人PBMC先天性免疫激活,还能诱导转基因hTLR8小鼠的特异性活性,但不能诱导野生型小鼠的特异性活性的研究结果。在此次的Hep-DART2023大会上,研究人员还发表了对Bepirovirsen先天性免疫激活机制以及定位激活源自肝脏哪个部位的研究结果。
对WT同窝对照小鼠和转基因hTLR8小鼠施用Bepirovirsen、其他ASO(包括一种scrambledASO、一种微炎ASO和一种TLR9激活ASO)或对照处理。小鼠在服药四小时后安乐死,并检测血浆蛋白和肝脏RNA细胞因子水平。为了研究细胞因子激活的位置,使用RNAscope对固定肝脏样本中特定基因mRNA进行染色。
结果显示,与测试的其他ASO相比,Bepirovirsen在先天免疫激活方面具有独特的特征。施用Bepirovirsen的hTLR8小鼠血浆TNF-α和IL-6水平显著高于施用scrambledASO的小鼠(TNF-α:p<0.0001;IL-6:p=0.0169)或微炎性ASO104838(p=0.025,p=0.0346)。Bepirovirsen在hTLR8小鼠中诱导TNF-α和IL-6,而在WT小鼠中则没有,而ASO421856(通过TLR9激活)在hTLR8和WT小鼠中均诱导TNF-α和IL-6。
Bepirovirsen用药4小时后,在肝脏总RNA中观察到细胞因子/趋化因子(如Ccl2、Ccl4和Tnf)的表达升高。通过对肝脏切片(N=2)进行RNAscope检测,这种诱导主要定位于Kupffer细胞和巨噬细胞,而不是肝细胞。
因此,研究确定Bepirovirsen在hTLR8转基因小鼠中的先天性免疫激活与另一种已知能诱导TLR9活性的ASO不同,这表明Bepirovirsen介导的先天性反应对人类TLR8更有特异性。
Bepirovirsen全球临床试验进度及信息查询

图片来源:药融云全球临床试验数据库
与此同时,2023年2月,GSK已经启动了两项随机、双盲、安慰剂对照的3期研究(分别是B-Well1和B-Well2),评估bepirovirsen(原IONIS-HBVRx)的安全性和有效性,这是一种用于治疗慢性乙肝感染(CHB)患者的研究性反义药物。
III期临床试验研究的数据旨在确认Bepirovirsen用于慢性HBV感染受试者的有效性,并确立其安全性特征,为评估获益/风险关系、支持其上市批准提供充分的依据。
反义寡核苷酸(ASO)主要药物
1998年8月,第一个ASO药物——Fomivirsen(Vitravene)经美国FDA批准上市,是由全球ASO药物领军企业Ionis Pharmaceuticals公司(伊奥尼斯制药公司)和诺华公司合作研发,用于治疗人类免疫缺陷病毒(human immunodeficiency virus,HIV)阳性患者并发的巨细胞病毒性(cytomegalovirus,CMV)视网膜炎(后因肝毒性该药于2002年于欧洲退市,2007年于美国退市),距离1978年ASO概念的提出,正好经过了20年时间。
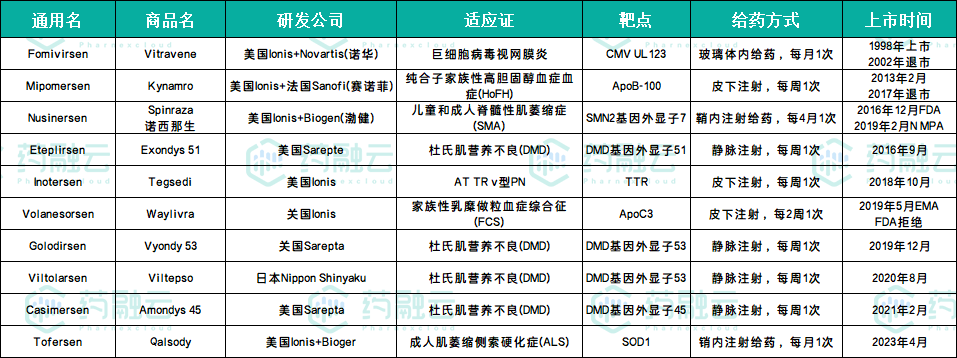
据药融云数据库统计,截止到2023年11月,目前全球已经上市的ASO药物有10种,包括Fomivirsen(Vitravene)、Mipomersen(Kynamro)、Inotersen(Tegsedi)、Volanesorsen(Waylivra)、Tofersen(Qalsody)、Nusinersen(Spinraza)、Eteplirsen(Exondys 51)、Golodirsen(Vyondy 53)、Casimersen(Amondys 45)、Viltolarsen(Viltepso)、Tofersen(Qalsody)。
获批上市的ASO药物汇总(截止到2023年11月)
数据来源:药融云数据库
在抗乙型肝炎病毒(HBV)反义寡核苷酸药物研究领域,代表药物除了Ionis公司的 GSK33389404(IONIS-HBV-LRx)、GSK3228836(GSK836,IONIS-HBVRx),还有ALG-ASO和HBV-LNA ASO、AHB-137等。
ALG-ASO(ALG-020572)
ALG-ASO 是由 Aligos Therapeutics 公司研发的一款反义寡核苷酸(ASO),该款药物采用两种触发物(S + X),已有的研究结果显示,该药经多天给药后,针对肝脏的先导序列在小鼠HBV模型中分别表现出出色的安全性和有效性。在体外,已证明在抑制 HepG2.2.15细胞中的HBsAg方面,反义寡核苷酸(ASO)跟抑制s抗原转运的寡核苷酸聚合物(STOP)的组合具有明显的协同作用。
但2022年3月,Aligos Therapeutics宣布停止开发其候选药物ALG-020572,终止开发的原因主要是因为在 ALG-020572-401研究中,一名慢性乙型肝炎(CHB)受试者在多次给药 210 mg ALG-020572后出现严重不良事件 (SAE),导致丙氨酸氨基转移酶 (ALT) 显著增加并短暂住院。这名患者是该队列中四名CHB受试者之一,可能经历了与药物相关的ALT突然发作,提示药物引起了肝毒性。
HBV-LNA ASO
HBV-LNA ASO 是由罗氏公司研发的一款锁核酸反义寡核苷酸,靶向所有病毒RNA转录本,是采用三个N-乙酰半乳糖胺部分的共价连接簇来确保肝细胞特异性递送。RO7020531是Toll样受体7(TLR7)激动剂的前药。乙肝动物模型研究显示,HBV-LNA ASO 和 RO7020531 的所有组合均明显优于各自单一疗法。HBV-LNA ASO 单一疗法可在治疗期间将 HBsAg 降低 2.8log。
AHB-137
AHB-137是浩博医药(AusperBio)研发的在研乙肝新药,靶点与bepirovirsen(GSK3228836,GSK836)相同。AHB-137是一种新型强效乙肝病毒反义寡核苷酸,其临床前研究数据显示,新型HBV ASO AHB-137除具有强大有效抗病毒活性外,还表现出良好的临床前药代动力学和安全性特征。目前处于Phase 1期临床试验阶段。
2023年3月,AHB-137进入首次人体临床试验,2023年6月获得CDE临床试验批件并于8月24日在中国完成一期临床试验首组人体给药,暂未有临床数据公开公布。同年8月25日, AHB-137 获得美国食品药品监督管理局(FDA)批准开展慢性乙肝病人临床试验。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
本文地址:http://nhjcxspj.xhstdz.com/quote/3746.html 物流园资讯网 http://nhjcxspj.xhstdz.com/ , 查看更多

